中國科學院南海海洋研究所王曉雪研究員團隊,2025年9月20日在微生物領域國際權威期刊FEMS Microbiology Reviews發表題為“Post-translational Modifications of the Nucleoid Protein H-NS: Sites,Mechanisms,and Regulatory Cues”的綜述論文。該研究系統梳理細菌類組蛋白H-NS的多種翻譯后修飾模式,提出這些修飾模式構成“細菌類組蛋白密碼”,揭示H-NS通過翻譯后修飾驅動細菌基因組進化的精密機制,為理解細菌環境適應、致病機制及開發新型抗菌策略提供重要理論支撐。博士后劉亞博為第一作者,研究員王曉雪為通訊作者。
基因組壓縮與動態調控是生命體共通的核心科學問題。細菌缺乏真核生物核小體結構,主要依賴H-NS等核結合蛋白實現基因組的壓縮與調控功能。H-NS可沉默原噬菌體、毒力島等外來基因元件,維持基因組穩定性。研究發現細菌又能在特定環境下解除H-NS的沉默并激活外源基因表達,這一過程是細菌環境適應的關鍵過程。但細菌宿主如何感應外界環境變化,通過H-NS實現對外來基因元件的精準調控是領域內備受關注的科學問題。
研究整合大腸桿菌、銅綠假單胞菌、希瓦氏菌和殺魚愛德華氏菌等多物種證據,闡釋H-NS通過其N端寡聚化域、中間柔性連接區和C端DNA結合域發生多種翻譯后修飾調控其沉默功能:N端修飾調整H-NS聚合狀態,掌控基因沉默開關;中間區修飾重塑電荷分布;C端修飾直接改變其對高AT含量DNA的結合能力(圖1)。
翻譯后修飾是拮抗H-NS沉默的關鍵機制,與已知的抗沉默蛋白、小分子代謝物及蛋白酶解等途徑協同作用,通過感知環境信號、傳導調控指令,最終實現表型輸出,助力細菌利用外源基因增強環境適應性。尤為重要的是,研究進一步提出,外源基因常編碼修飾酶或抗沉默蛋白,在激活條件下解除H-NS介導的基因沉默。這一由外來元件參與的主動“轉錄解抑制”過程充分呈現了細菌與外來基因元件間的競爭與協作關系,是系統認識微生物中水平基因轉移的重要視角。
本研究工作得到國家自然科學基金、國家科技基礎資源調查專項、中國博士后科學基金及ONCE等項目的資助。
相關論文信息:Yabo Liu,Xiaoxue Wang*. Post-translational modifications of the nucleoid protein H-NS: sites,mechanisms,and regulatory cues.?2025,FEMS Microbiology Reviews,fuaf045.?
論文鏈接:https://doi.org/10.1093/femsre/fuaf045
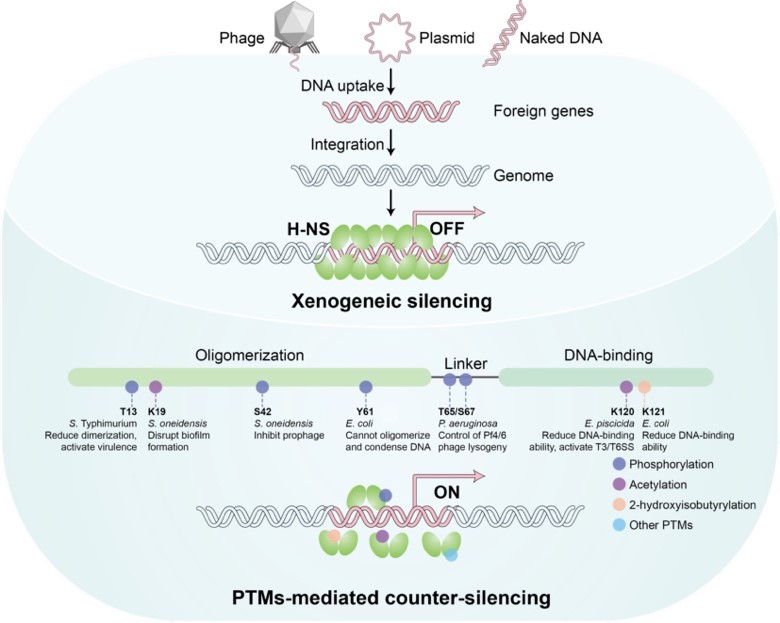
圖1?H-NS沉默外源基因表達與翻譯后修飾介導抗沉默機制
附件下載:


